- 猪用生物制品及相关猪源原辅材料中,非洲猪瘟病毒核酸检测方法 -
- 发布时间:2019-09-27 14:10 浏览:加载中
次
-
1 适用范围
1.1猪用及采用猪源原辅材料制备的生物制品成品及半成品。
1.2猪源毒种。
1.3 猪源细胞及相关制品生产用细胞。
1.4其他猪源原辅材料(如组织、血清、胰酶衍生物等)。
2 取样和处理
2.1 疫苗
2.1.1 活疫苗 取至少2瓶样品,按瓶签注明头份用适宜稀释液分别稀释成10头份/0.2ml,等量混合,取混合液进行核酸提取。
2.1.2 灭活疫苗 取至少2瓶样品,等量混合后进行以下处理。
2.1.2.1 油佐剂灭活疫苗 取36 ml混合疫苗,加入正戊醇4.0 ml,充分振荡混合1分钟,2~8℃冰箱静置不少于60分钟,直至油相和水相分离。取水相进行核酸提取。
2.1.2.2 水性佐剂灭活疫苗
2.1.2.2.1铝胶佐剂灭活疫苗 取混合疫苗5.0 ml,摇匀,加入0.25 g解离剂CPG-odn(人工合成的寡聚核苷酸),放入摇床(200 r/min)37℃解离1小时,5000 r/min离心10分钟,取上清液进行核酸提取。
2.1.2.2.2其他水性佐剂灭活疫苗 直接取混合样品进行核酸提取。
2.2 其他生物制品和半成品冻干类制品,按活疫苗进行取样和处理;液体制品及半成品,取至少2份(瓶)样品,等量混合,取混合液进行核酸提取。
2.3 猪源毒种 取至少2支毒种。冻干毒种,按冻干前体积复溶后等量混合,取混合液进行核酸提取;非冻干毒种,等量混合后直接取混合液进行核酸提取。
2.4 猪源细胞 除另有规定外,取至少2瓶细胞浓度不少于107.0个细胞/ml的细胞悬液进行核酸提取。
2.5 其他猪源原辅材料
2.5.1 猪组织 每种组织,分别取样和处理。取不少于2.0 g组织,研磨后用5倍体积灭菌PBS悬浮,70℃灭活30分钟,4℃下以2000~3000 g离心10分钟,取上清液进行核酸提取。
2.5.2 猪血清 每批血清取至少2个最小包装的样品,等量混合,取混合液进行核酸提取。
2.5.3 猪胰酶 干粉状胰酶,取至少2份样品,根据使用情况分别配制成不低于2.5%浓度的溶液,等量混合,取混合液进行核酸提取;液体胰酶,取至少2个最小包装的样品,等量混合,取混合液进行核酸提取。
2.5.4 其他猪源衍生物 固体、液体或干粉状猪源衍生物,可分别按组织、血清或干粉状胰酶的方法进行取样和样品处理。
3 核酸提取
3.1 试剂和器材
3.1.1 试剂 根据核酸提取方法确定,如氯仿、异丙醇、无水乙醇、0.1 mol/l 柠檬酸钠(含10%乙醇)、75%乙醇等。
3.1.2 仪器 核酸含量测定仪;常温台式离心机;旋涡振荡器;水浴锅;微量移液器1套(最大量程分别为10 µl、100 µl、200 µl、1000 µl)。
3.1.3 耗材 1.5 ml带盖离心管、无菌吸头(0~10 µl、0~200 µl、100~1000 µl)、一次性乳胶手套。
3.2 操作程序(TRIZOL法),也可以选择其他等效核酸提取方法提取样品中的DNA。
3.2.1 取样品250 µl,加入750 µl Trizol,颠倒混匀,室温放置5分钟。
3.2.2 加入200 µl氯仿,充分混匀,室温放置10 分钟,4℃下以12000 g离心15 分钟。
3.2.3 弃去上清液,加入220 µl无水乙醇,颠倒混合,15~30℃放置2~3分钟,2~8℃以2000 g离心5分钟,沉淀物为DNA。
3.2.4 弃去上清液,加入含10%乙醇的0.1 mol/l 柠檬酸钠750 µl洗涤DNA,15~30℃放置30分钟,2~8℃以2000 g离心5分钟。重复一次。
3.2.5 加入75%乙醇1.2 ml,重悬DNA沉淀,15~30℃放置20分钟,4℃2000 g离心5分钟。可重复一次,充分洗涤DNA沉淀。
3.2.6 弃去上清液,敞开离心管管口,在空气中干燥5~10分钟,加入30~50 μl的无核酸酶灭菌水溶解DNA,-20℃以下保存备用。
3.3 注意事项
3.3.1核酸提取试剂具有腐蚀和强变性能力,应做好个人防护,佩戴手套、口罩和护目镜,防止液体飞溅到皮肤和眼睛。
3.3.2后续的核酸检测敏感性很高,要防止样品之间相互污染,最好使用带滤芯的枪头,且每次吸取取液体时均需更换枪头。
3.3.3为防止核苷酸降解,应避免核酸酶污染,使用的耗材均需无核酸酶。
3.3.4做好剩余样品的无害化处理及操作台面的消毒处理。剩余样品可通过高压灭菌或煮沸处理,也可放在1%卫可或2%氢氧化钠消毒液中浸泡处理,操作台面使用1%卫可擦拭。
3.3.5提取后的DNA样品要用锡箔纸封存,取样时应用枪头直接刺破锡箔纸取样,防止污染。
4 检测
下列两种方法可任选其一。
4.1 实时荧光定量PCR检测法
4.1.1 试剂和器材
4.1.1.1 试剂
4.1.1.1.1 荧光定量PCR试剂 本操作中以Applied Biosystems TaqMan Gene Expression Assays kit为例,也可选用其他荧光定量PCR试剂。
4.1.1.1.2 扩增引物及探针
扩增引物:
ASF-05-Zsak-1466F(10 µmol/ L):5'-CCTCGGCGAGCGCTTTATCAC-3'
ASF-05-Zsak-1528R(10 µmol/ L):5'-GGAAACTCATTCACCAAATCCTT-3'
探针ASF-05-Zsak-1486prob (10 µmol/ L):5'-FAM-CGATGCAAGCTTTAT-MGB-3'
4.1.1.1.3 无核酸酶的灭菌水 PCR级别。
4.1.1.2 仪器 荧光定量PCR仪;微量移液器1套(最大量程分别为10 µl、100 µl、200 µl、1000 µl)。
4.1.1.3 耗材 1.5 ml带盖离心管、0.2 ml薄壁PCR管、荧光定量PCR 96孔板、0.1 ml荧光PCR八连管、无菌吸头(0~10 µl、0~200 µl、100~1000 µl)、一次性乳胶手套。
4.1.2 操作程序
4.1.2.1 样品DNA制备 按照前述方法进行核酸提取。
4.1.2.2 反应体系的配制 配制比样品数量至少多4个的反应体系,同时设置强阳性、弱阳性和阴性对照。在强阳性和弱阳性对照反应管中分别加入含有非洲猪瘟P72基因的标准质粒DNA各3 µl,在阴性对照反应管中加入3µl无核酸酶灭菌水。每个PCR反应管中应包含以下成分:
 4.1.2.3 反应程序 将所有待检样品和强阳性、弱阳性、阴性对照反应管放在荧光定量PCR仪中,按照以下程序进行扩增:50℃2分钟,95℃5分钟,95℃15秒,58℃退火延伸1分钟,45个循环(荧光信号收集在此阶段每次循环的退火延伸时进行)。
4.1.2.4 结果判定
4.1.2.4.1 阈值设定 试验操作结束后,确定Ct值。Ct值为每个样品反应管内荧光信号到达设定阈值时所经历的循环数。
阈值设定原则:根据仪器噪声情况进行调整,以阈值线刚好超过阴性对照扩增曲线的最高点为准。
4.1.2.4.2 质控标准
对照组的检测结果应符合以下情况,此次检测方为有效:
阴性对照无Ct 值,且无扩增曲线。
强阳性对照的Ct 值应在18~22之间,并出现典型的扩增曲线。弱阳性对照的Ct 值应在33~35之间,并出现典型的扩增曲线。
4.1.2.4.3 判定
阴性:无Ct值,且未出现扩增曲线,判定为样品中无ASFV核酸。
阳性:Ct值≤40,且出现典型的扩增曲线,判定为样品中存在ASFV核酸。
可疑:Ct值>40,且出现典型扩增曲线,判定为可疑,应重检。重检后,Ct值≤40且出现典型扩增曲线者判为阳性,其他情况均判定为阴性。
4.2 普通 PCR检测法
4.2.1 试剂和器材
4.2.1.1 试剂
4.2.1.1.1 PCR试剂 10×PCR缓冲液(含25 mmol/l Mg2+),DNA扩增酶,dNTP预混液。
4.2.1.1.2扩增引物
primer PPA-1(10 μmol/L):5'-AGTTATGGGAAACCCGACCC-3' (上游引物);
primer PPA-2(10 μmol/L):5'- CCCTGAATCGGAGCATCCT-3' (下游引物)。
4.2.1.1.3 DNA分子量标准品 DL500。
4.2.1.1.4 TAE电泳缓冲液 配制方法见《电泳液标准配制流程》。
4.2.1.1.5 1%琼脂糖凝胶板 在100 ml 1×TAE缓冲液中加入1g琼脂糖,加热融化,加入5.0 μl (10 mg/ml)溴化乙锭,混匀,倒入水平放置的凝胶盘中,胶板厚度达5.0 mm左右。根据样品数量选用适宜的梳子。待凝胶冷却凝固后拔出梳子(胶中形成加样孔),放入电泳槽中,加1×TAE缓冲液淹没胶面。
4.2.1.2 仪器 DNA扩增仪,稳压稳流电泳仪,水平电泳槽,凝胶成相系统(或紫外透射仪),微量移液器1套。
4.2.1.3 耗材 1.5 ml带盖离心管、0.2 ml薄壁PCR管、无菌吸头(0~10 µl、0~200 µl、100~1000 µl)。
4.2.2 操作程序
4.2.2.1 样品DNA制备 按照前述方法进行核酸提取。
4.2.2.2 反应体系的配制 配制比样品数量至少多3个的反应体系,同时设立阳性和阴性对照。在阳性对照反应管中加入非洲猪瘟P72基因重组质粒2.0 µl,在阴性对照反应管中加入2.0 µl无核酸酶灭菌水。每个PCR反应管中应包含以下成分:
4.1.2.3 反应程序 将所有待检样品和强阳性、弱阳性、阴性对照反应管放在荧光定量PCR仪中,按照以下程序进行扩增:50℃2分钟,95℃5分钟,95℃15秒,58℃退火延伸1分钟,45个循环(荧光信号收集在此阶段每次循环的退火延伸时进行)。
4.1.2.4 结果判定
4.1.2.4.1 阈值设定 试验操作结束后,确定Ct值。Ct值为每个样品反应管内荧光信号到达设定阈值时所经历的循环数。
阈值设定原则:根据仪器噪声情况进行调整,以阈值线刚好超过阴性对照扩增曲线的最高点为准。
4.1.2.4.2 质控标准
对照组的检测结果应符合以下情况,此次检测方为有效:
阴性对照无Ct 值,且无扩增曲线。
强阳性对照的Ct 值应在18~22之间,并出现典型的扩增曲线。弱阳性对照的Ct 值应在33~35之间,并出现典型的扩增曲线。
4.1.2.4.3 判定
阴性:无Ct值,且未出现扩增曲线,判定为样品中无ASFV核酸。
阳性:Ct值≤40,且出现典型的扩增曲线,判定为样品中存在ASFV核酸。
可疑:Ct值>40,且出现典型扩增曲线,判定为可疑,应重检。重检后,Ct值≤40且出现典型扩增曲线者判为阳性,其他情况均判定为阴性。
4.2 普通 PCR检测法
4.2.1 试剂和器材
4.2.1.1 试剂
4.2.1.1.1 PCR试剂 10×PCR缓冲液(含25 mmol/l Mg2+),DNA扩增酶,dNTP预混液。
4.2.1.1.2扩增引物
primer PPA-1(10 μmol/L):5'-AGTTATGGGAAACCCGACCC-3' (上游引物);
primer PPA-2(10 μmol/L):5'- CCCTGAATCGGAGCATCCT-3' (下游引物)。
4.2.1.1.3 DNA分子量标准品 DL500。
4.2.1.1.4 TAE电泳缓冲液 配制方法见《电泳液标准配制流程》。
4.2.1.1.5 1%琼脂糖凝胶板 在100 ml 1×TAE缓冲液中加入1g琼脂糖,加热融化,加入5.0 μl (10 mg/ml)溴化乙锭,混匀,倒入水平放置的凝胶盘中,胶板厚度达5.0 mm左右。根据样品数量选用适宜的梳子。待凝胶冷却凝固后拔出梳子(胶中形成加样孔),放入电泳槽中,加1×TAE缓冲液淹没胶面。
4.2.1.2 仪器 DNA扩增仪,稳压稳流电泳仪,水平电泳槽,凝胶成相系统(或紫外透射仪),微量移液器1套。
4.2.1.3 耗材 1.5 ml带盖离心管、0.2 ml薄壁PCR管、无菌吸头(0~10 µl、0~200 µl、100~1000 µl)。
4.2.2 操作程序
4.2.2.1 样品DNA制备 按照前述方法进行核酸提取。
4.2.2.2 反应体系的配制 配制比样品数量至少多3个的反应体系,同时设立阳性和阴性对照。在阳性对照反应管中加入非洲猪瘟P72基因重组质粒2.0 µl,在阴性对照反应管中加入2.0 µl无核酸酶灭菌水。每个PCR反应管中应包含以下成分:
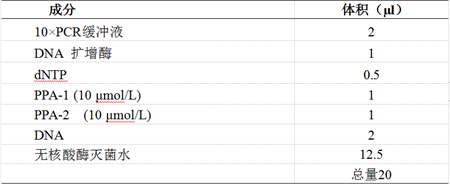 4.2.2.3 反应程序 将所有待检样品及阳性和阴性对照反应管放在PCR仪中,按照以下程序进行扩增:94℃2分钟,94℃30秒,60℃30秒,72℃30秒,35个循环;72℃10分钟。4℃保存。
4.2.2.4 PCR扩增产物分析 取PCR扩增产物10 µl,加6×加样缓冲液2.0 µl,混匀,用1.5%琼脂糖凝胶对混合物进行电泳分析,电压120V,电流50 mA,电泳时间30分钟。电泳结束后,用凝胶成像系统拍照,记录检测结果。
4.2.2.5 结果判定
4.2.2.5.1 质控标准
对照组的检测结果应符合以下情况,此次检测方为有效:
阴性对照应不出现257bp的特异性条带。
阳性对照应出现257bp的特异性条带。
4.2.2.5.2 判定
阳性:待检样品出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阳性,扩增产物可通过DNA测序进一步确定基因型。
阴性:待检样品未出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阴性。
4.3 注意事项
4.3.1检测过程中应遵循PCR实验分区原则,即应区分试剂配制区、样本处理区、核酸扩增区。
4.3.2应避免在含有靶序列的区域中使用引物,防止污染靶序列。
4.2.2.3 反应程序 将所有待检样品及阳性和阴性对照反应管放在PCR仪中,按照以下程序进行扩增:94℃2分钟,94℃30秒,60℃30秒,72℃30秒,35个循环;72℃10分钟。4℃保存。
4.2.2.4 PCR扩增产物分析 取PCR扩增产物10 µl,加6×加样缓冲液2.0 µl,混匀,用1.5%琼脂糖凝胶对混合物进行电泳分析,电压120V,电流50 mA,电泳时间30分钟。电泳结束后,用凝胶成像系统拍照,记录检测结果。
4.2.2.5 结果判定
4.2.2.5.1 质控标准
对照组的检测结果应符合以下情况,此次检测方为有效:
阴性对照应不出现257bp的特异性条带。
阳性对照应出现257bp的特异性条带。
4.2.2.5.2 判定
阳性:待检样品出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阳性,扩增产物可通过DNA测序进一步确定基因型。
阴性:待检样品未出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阴性。
4.3 注意事项
4.3.1检测过程中应遵循PCR实验分区原则,即应区分试剂配制区、样本处理区、核酸扩增区。
4.3.2应避免在含有靶序列的区域中使用引物,防止污染靶序列。

 4.1.2.3 反应程序 将所有待检样品和强阳性、弱阳性、阴性对照反应管放在荧光定量PCR仪中,按照以下程序进行扩增:50℃2分钟,95℃5分钟,95℃15秒,58℃退火延伸1分钟,45个循环(荧光信号收集在此阶段每次循环的退火延伸时进行)。
4.1.2.4 结果判定
4.1.2.4.1 阈值设定 试验操作结束后,确定Ct值。Ct值为每个样品反应管内荧光信号到达设定阈值时所经历的循环数。
阈值设定原则:根据仪器噪声情况进行调整,以阈值线刚好超过阴性对照扩增曲线的最高点为准。
4.1.2.4.2 质控标准
对照组的检测结果应符合以下情况,此次检测方为有效:
阴性对照无Ct 值,且无扩增曲线。
强阳性对照的Ct 值应在18~22之间,并出现典型的扩增曲线。弱阳性对照的Ct 值应在33~35之间,并出现典型的扩增曲线。
4.1.2.4.3 判定
阴性:无Ct值,且未出现扩增曲线,判定为样品中无ASFV核酸。
阳性:Ct值≤40,且出现典型的扩增曲线,判定为样品中存在ASFV核酸。
可疑:Ct值>40,且出现典型扩增曲线,判定为可疑,应重检。重检后,Ct值≤40且出现典型扩增曲线者判为阳性,其他情况均判定为阴性。
4.2 普通 PCR检测法
4.2.1 试剂和器材
4.2.1.1 试剂
4.2.1.1.1 PCR试剂 10×PCR缓冲液(含25 mmol/l Mg2+),DNA扩增酶,dNTP预混液。
4.2.1.1.2扩增引物
primer PPA-1(10 μmol/L):5'-AGTTATGGGAAACCCGACCC-3' (上游引物);
primer PPA-2(10 μmol/L):5'- CCCTGAATCGGAGCATCCT-3' (下游引物)。
4.2.1.1.3 DNA分子量标准品 DL500。
4.2.1.1.4 TAE电泳缓冲液 配制方法见《电泳液标准配制流程》。
4.2.1.1.5 1%琼脂糖凝胶板 在100 ml 1×TAE缓冲液中加入1g琼脂糖,加热融化,加入5.0 μl (10 mg/ml)溴化乙锭,混匀,倒入水平放置的凝胶盘中,胶板厚度达5.0 mm左右。根据样品数量选用适宜的梳子。待凝胶冷却凝固后拔出梳子(胶中形成加样孔),放入电泳槽中,加1×TAE缓冲液淹没胶面。
4.2.1.2 仪器 DNA扩增仪,稳压稳流电泳仪,水平电泳槽,凝胶成相系统(或紫外透射仪),微量移液器1套。
4.2.1.3 耗材 1.5 ml带盖离心管、0.2 ml薄壁PCR管、无菌吸头(0~10 µl、0~200 µl、100~1000 µl)。
4.2.2 操作程序
4.2.2.1 样品DNA制备 按照前述方法进行核酸提取。
4.2.2.2 反应体系的配制 配制比样品数量至少多3个的反应体系,同时设立阳性和阴性对照。在阳性对照反应管中加入非洲猪瘟P72基因重组质粒2.0 µl,在阴性对照反应管中加入2.0 µl无核酸酶灭菌水。每个PCR反应管中应包含以下成分:
4.1.2.3 反应程序 将所有待检样品和强阳性、弱阳性、阴性对照反应管放在荧光定量PCR仪中,按照以下程序进行扩增:50℃2分钟,95℃5分钟,95℃15秒,58℃退火延伸1分钟,45个循环(荧光信号收集在此阶段每次循环的退火延伸时进行)。
4.1.2.4 结果判定
4.1.2.4.1 阈值设定 试验操作结束后,确定Ct值。Ct值为每个样品反应管内荧光信号到达设定阈值时所经历的循环数。
阈值设定原则:根据仪器噪声情况进行调整,以阈值线刚好超过阴性对照扩增曲线的最高点为准。
4.1.2.4.2 质控标准
对照组的检测结果应符合以下情况,此次检测方为有效:
阴性对照无Ct 值,且无扩增曲线。
强阳性对照的Ct 值应在18~22之间,并出现典型的扩增曲线。弱阳性对照的Ct 值应在33~35之间,并出现典型的扩增曲线。
4.1.2.4.3 判定
阴性:无Ct值,且未出现扩增曲线,判定为样品中无ASFV核酸。
阳性:Ct值≤40,且出现典型的扩增曲线,判定为样品中存在ASFV核酸。
可疑:Ct值>40,且出现典型扩增曲线,判定为可疑,应重检。重检后,Ct值≤40且出现典型扩增曲线者判为阳性,其他情况均判定为阴性。
4.2 普通 PCR检测法
4.2.1 试剂和器材
4.2.1.1 试剂
4.2.1.1.1 PCR试剂 10×PCR缓冲液(含25 mmol/l Mg2+),DNA扩增酶,dNTP预混液。
4.2.1.1.2扩增引物
primer PPA-1(10 μmol/L):5'-AGTTATGGGAAACCCGACCC-3' (上游引物);
primer PPA-2(10 μmol/L):5'- CCCTGAATCGGAGCATCCT-3' (下游引物)。
4.2.1.1.3 DNA分子量标准品 DL500。
4.2.1.1.4 TAE电泳缓冲液 配制方法见《电泳液标准配制流程》。
4.2.1.1.5 1%琼脂糖凝胶板 在100 ml 1×TAE缓冲液中加入1g琼脂糖,加热融化,加入5.0 μl (10 mg/ml)溴化乙锭,混匀,倒入水平放置的凝胶盘中,胶板厚度达5.0 mm左右。根据样品数量选用适宜的梳子。待凝胶冷却凝固后拔出梳子(胶中形成加样孔),放入电泳槽中,加1×TAE缓冲液淹没胶面。
4.2.1.2 仪器 DNA扩增仪,稳压稳流电泳仪,水平电泳槽,凝胶成相系统(或紫外透射仪),微量移液器1套。
4.2.1.3 耗材 1.5 ml带盖离心管、0.2 ml薄壁PCR管、无菌吸头(0~10 µl、0~200 µl、100~1000 µl)。
4.2.2 操作程序
4.2.2.1 样品DNA制备 按照前述方法进行核酸提取。
4.2.2.2 反应体系的配制 配制比样品数量至少多3个的反应体系,同时设立阳性和阴性对照。在阳性对照反应管中加入非洲猪瘟P72基因重组质粒2.0 µl,在阴性对照反应管中加入2.0 µl无核酸酶灭菌水。每个PCR反应管中应包含以下成分:
 4.2.2.3 反应程序 将所有待检样品及阳性和阴性对照反应管放在PCR仪中,按照以下程序进行扩增:94℃2分钟,94℃30秒,60℃30秒,72℃30秒,35个循环;72℃10分钟。4℃保存。
4.2.2.4 PCR扩增产物分析 取PCR扩增产物10 µl,加6×加样缓冲液2.0 µl,混匀,用1.5%琼脂糖凝胶对混合物进行电泳分析,电压120V,电流50 mA,电泳时间30分钟。电泳结束后,用凝胶成像系统拍照,记录检测结果。
4.2.2.5 结果判定
4.2.2.5.1 质控标准
对照组的检测结果应符合以下情况,此次检测方为有效:
阴性对照应不出现257bp的特异性条带。
阳性对照应出现257bp的特异性条带。
4.2.2.5.2 判定
阳性:待检样品出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阳性,扩增产物可通过DNA测序进一步确定基因型。
阴性:待检样品未出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阴性。
4.3 注意事项
4.3.1检测过程中应遵循PCR实验分区原则,即应区分试剂配制区、样本处理区、核酸扩增区。
4.3.2应避免在含有靶序列的区域中使用引物,防止污染靶序列。
4.2.2.3 反应程序 将所有待检样品及阳性和阴性对照反应管放在PCR仪中,按照以下程序进行扩增:94℃2分钟,94℃30秒,60℃30秒,72℃30秒,35个循环;72℃10分钟。4℃保存。
4.2.2.4 PCR扩增产物分析 取PCR扩增产物10 µl,加6×加样缓冲液2.0 µl,混匀,用1.5%琼脂糖凝胶对混合物进行电泳分析,电压120V,电流50 mA,电泳时间30分钟。电泳结束后,用凝胶成像系统拍照,记录检测结果。
4.2.2.5 结果判定
4.2.2.5.1 质控标准
对照组的检测结果应符合以下情况,此次检测方为有效:
阴性对照应不出现257bp的特异性条带。
阳性对照应出现257bp的特异性条带。
4.2.2.5.2 判定
阳性:待检样品出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阳性,扩增产物可通过DNA测序进一步确定基因型。
阴性:待检样品未出现与阳性对照大小一致的扩增条带,判定为非洲猪瘟病毒核酸阴性。
4.3 注意事项
4.3.1检测过程中应遵循PCR实验分区原则,即应区分试剂配制区、样本处理区、核酸扩增区。
4.3.2应避免在含有靶序列的区域中使用引物,防止污染靶序列。